Unique Device Identification (UDI) für Medizinprodukte und In-vitro-Diagnostika (IVD)
Die Anforderungen mit GS1 Standards erfüllen
Was bedeutet Unique Device Identification?
Unique Device Identification (UDI) ist eine gesetzliche Vorgabe für die weltweit eindeutige und maschinenlesbare Kennzeichnung von Medizinprodukten und In-Vitro-Diagnostika. Sie gilt für Europa und die USA. Die erforderlichen Produktinformationen werden in der UDI-Datenbank vorgehalten. Das UDI-System erleichtert die Rückverfolgbarkeit von Medizinprodukten und erhöht die Patientensicherheit.
Ab dem 26. Mai 2025 müssen Medizinprodukte der Klasse 1, die nicht unter die Direktmarkierung fallen, auf der Kennzeichnung einen UDI Barcode haben.
GS1 ist offizielle UDI-Zuteilungsstelle. Wir bieten Lösungen für die eindeutige Kennzeichnung Ihrer Medizinprodukte. Mit Schulungen, individueller Beratung und einem starken Partnernetzwerk sind wir an Ihrer Seite.
Nutzen Sie die verbleibende Zeit und starten Sie jetzt mit der UDI-Umsetzung! Hier finden Sie alle relevanten Informationen und Kontakte.


GS1 Germany ist als Vergabestelle und neutrale Plattform sehr nah an der operativen Umsetzung. Das Berater-Team kennt sich bestens mit UDI und den Anforderungen aus - für uns bis heute ein zentraler Begleiter zu allen Fragen rund um MDR und UDI.
Sabine Bock
Director EMEA Quality ZEISS Vision Care
Alles, was Sie zur Basis UDI-DI wissen müssen
Im Gegensatz zu den USA wird in Europa zusätzlich zur UDI (UDI-DI = Device Identifier & UDI-PI = Production Identifer) noch die Basis UDI-DI benötigt. MDR (Medical Device Regulation) und IVDR (In-vitro-Diagnostika Regulation) definieren die Basis UDI-DI als die primäre Kennung eines Produktmodells, welche auf Ebene der Gebrauchseinheit des Produkts zugewiesen wird. Sie ist das wichtigste Ordnungsmerkmal für Datensätze in der UDI-Datenbank und ist in den einschlägigen Bescheinigungen und EU-Konformitätserklärungen ausgewiesen. Mehr zur Basis UDI-DI erfahren Sie in unseren kurzen Video.
Merkmale der Basis UDI-DI
- kennzeichnet eine gesamte Produktfamilie
- erscheint in der EUDAMED
- fasst mehrere UDI-DI zusammen
- muss in allen relevanten Dokumenten erscheinen
- erscheint NICHT auf Produkten und Verpackungen
- Wird mit dem GS1 Standard GMN gebildet (Global Model Number)
Um die GMN-Prüfzeichen zu berechnen oder Ihre GMN (Basis UDI-DI) zu überprüfen, können Sie den von GS1 entwickelten Prüfzeichenpaarrechner verwenden. Klicken Sie hier, um darauf zuzugreifen.
Abgrenzung der Basis UDI-DI zur UDI-DI
Die Basis UDI-DI kennzeichnet ein Produktmodell oder eine gesamte Produktfamilie. Neben derselben Basis UDI-DI besitzt jedes einzelne Produkt aus dieser Produktfamilie eine eigene eindeutige Nummer. Diese Nummer ist die UDI-DI. Die Basis UDI-DI erscheint in der EUDAMED-Datenbank und in den offiziellen Dokumenten. Sie erscheint nie – im Vergleich zur UDI-DI - auf dem Produkt oder deren Verpackung.
Kennzeichnung von Medizinprodukten mit GS1 Standards
Mit den GS1 Standards erfüllen Sie als Hersteller von Medizinprodukten und In-Vitro Diagnostika die UDI-Anforderungen für die USA und Europa. Bei der UDI-Umsetzung geht es im Kern um drei Handlungsfelder:
EU UDI-Anforderungen
Alle Medizinprodukte und In-Vitro-Diagnostika müssen weltweit eindeutig identifizierbar sein.
UDI Device Identifier (UDI-DI)
Der UDI-DI ist ein einmaliger numerischer oder alphanumerischer Code, der den Artikel identifiziert (statische Daten).
UDI Production Identifier (UDI-PI)
Der UDI-PI ermöglicht die Rückverfolgbarkeit mit Daten wie Charge,Verfallsdatum, Seriennummer (dynamische Daten).
Basis UDI-DI
Die Basis UDI-DI ist die primäre Kennung eines Produktmodells, welche auf Ebene der Gebrauchseinheit des Produkts zugewiesen wird. Sie ist das wichtigste Ordnungsmerkmal für Datensätze in der UDI-Datenbank und ist in den einschlägigen Bescheinigungen und EU-Konformitätserklärungen ausgewiesen.
Lösung mit GS1 Standards
Folgende GS1 Standards ermöglichen eine UDI konforme Identifikation Ihrer Produkte.
Global Trade Item Number (GTIN)
Als UDI-DI steht Ihnen die GTIN (Global Trade Item Number) zur Verfügung.
GS1 Datenbezeichner (DB)
Als UDI-PI bieten wir die GS1 Datenbezeichner (DB) an, auf Englisch GS1 Application Identifier (AI) genannt.
Global Model Number (GMN)
Für die Umsetzung der Basis UDI-DI kann die Global Model Number (GMN) verwendet werden. Die GMN ist der GS1 Identifikationsschlüssel, der das Modell eines Produktes, aus dem die Handelseinheit abgeleitet wird, identifiziert.
EU UDI-Anforderungen
UDI-Träger
Alle Informationen zu UDI-DI und UDI-PI müssen auf der Produktverpackung oder – wenn gefordert – auf dem Produkt selbst angebracht sein.
Lösungen mit GS1 Standards
GS1 Barcodes
Mit unseren Barcodes können Sie alle angeforderten Informationen maschinenlesbar darstellen:
- GS1-128-Strichcode: Linearer Strichcode
- GS1 DataMatrix: Zweidimensionaler Code
- RFID: Zusätzlich zu den GS1 Barcodes können Sie auch die RFID-Technologie verwenden
EU UDI-Anforderungen
Als Hersteller sind Sie verpflichtet, die Stammdaten Ihrer Produkte an die europäische UDI Datenbank (Teil der Europäischen Datenbank EUDAMED) zu liefern.
Lösung mit GDSN-Datenpool
Über das weltweite Netzwerk zum Datenaustausch GDSN können Sie Ihre UDI Daten über eine einzige Verbindung vielen Verwendern zur Verfügung stellen.
Sie suchen Partner, die Ihnen bei der Anbindung an die EUDAMED helfen? Dann schauen bei GS1 PINE – dem Partner Portal von GS1 Germany - vorbei.
Sie möchten UDI mit den GS1 Standards umsetzen? Werden Sie jetzt GS1 Complete Kunde.
Ihr Weg zu Unique Device Identification
Ein UDI-Projekt erreicht schnell eine hohe Komplexität mit vielen Abhängigkeiten und Auswirkungen auf unternehmensinterne Prozesse. Damit Sie den Überblick behalten, haben wir die wichtigsten Schritte für eine erfolgreiche UDI-Umsetzung für Sie zusammengestellt:
Best Practices: Erfolgreiche UDI-Umsetzung

ZEISS Vision Care: Individuelle Beratung
ZEISS Vision Care lässt sich zur internationalen Umsetzung der UDI-Verordnung von GS1 Germany Expertenteam beraten - mit nachhaltigem Erfolg. Mehr über die Zusammenarbeit lesen Sie in unserer Erfolgsstory.

Erbe Elektromedizin: Implementierung UDI
Die Produkte von Erbe Elektromedizin sind dank GTIN eindeutig identifizierbar. Das erfüllt nicht nur die neue EU-Verordnung MDR sondern bringt viele weitere Vorteile. Welche das sind, erfahren Sie in unserer Erfolgsstory.

Die Vorbereitung und Umsetzung der UDI ist ein intensiver, zeitaufwendiger Prozess und wir sind zum Glück früh gestartet. Durch den Support von GS1 konnten wir einzelne Unklarheiten schnell beseitigen und setzen alle Anforderungen fristgerecht um. Gemeinsam mit unseren Kunden freuen wir uns auf optimierte Abläufe in der Zusammenarbeit.
Hendrik Otto
Produktmanager mediPlac GmbH

GS1 Standards können weltweit verwendet werden, um die gesetzlichen UDI-Anforderungen zu erfüllen. So werden zur Zeit in der Europäischen Union, Brasilien, China, Ägypten, Saudi-Arabien, Singapur, Südkorea, Taiwan, der Türkei und den USA die GS1 Standards genutzt.
GS1 Germany
Unser UDI-Rundum-Angebot für Sie

Weiterbildung
Wir machen Sie fit für UDI
Lernen Sie, wie Sie die Anforderungen an UDI erfüllen und die GS1 Standards dazu nutzen können.

Beratung
Wir unterstützen Sie
Sie brauchen individuelle Beratung bei der Planung und Organisation von UDI? Unsere kompetenten Experten helfen Ihnen gerne!

Solution Partner
Unsere starken Partner
Die GS1 Solution Partner unterstützen Sie in der operativen Umsetzung von UDI.

Events
Unsere Events im Gesundheitswesen
Nutzen Sie unsere Events für Expertenaustausch und Know-how aus erster Hand innerhalb Ihrer Branchen.
Das sagen unsere Experten

UDI greift tief in die Prozesse von der Artikelanlage, über die IT bis in die Logistik ein. Meine Erfahrungen aus den Projekten mit den Herstellern zeigt, dass der Aufwand oftmals unterschätzt wird. Daher empfehle ich das UDI-Projekt abteilungsübergreifend aufzusetzen, um die Anforderungen von UDI richtig zu verstehen und das Projekt erfolgreich umsetzen zu können.
Julian Majert
Consultant bei GS1 Germany

Am 20. März 2023 wurden im Amtsblatt der Europäischen Kommission die verlängerten Übergangsfristen der MDR (Medical Device Regulation) veröffentlicht. Die verlängerten Übergangsfristen sind allerdings an bestimmte Bedingungen geknüpft. Umso wichtiger ist es, dass Hersteller ein klares Bild vor Augen haben, was im Zusammenhang mit UDI auf ihr Unternehmen zukommt und was in der Umsetzung der Anforderungen zu beachten ist.
Guido M. Hammer
Senior Consultant bei GS1 Germany
FAQs zu Unique Device Identification
Die UDI-DI (UDI Device Identifier) ist ein einmaliger numerischer oder alphanumerischer Code, der einem Produktmodell eigen ist und der auch als „Zugangsschlüssel“ zu Informationen in einer UDI-Datenbank dient. Sie ist auf allen Ebenen der Produktverpackung einmalig.
Zur Identifikation Ihrer Produkte und der verfügbaren Verpackungsebenen verwenden Sie jeweils eine GTIN – Global Trade Item Number.
Bitte beachten Sie bei der Zuteilung aller Identifikationsnummern die vom Gesetzgeber definierten Vergabe- und Änderungsregeln (siehe MDR/IVDR Anhang VI Teil C Absatz 3 und 6) sowie die GTIN-Vergaberegeln im Gesundheitswesen.
Im Unterschied zu den USA wird für Europa neben dem UDI Device Identifier (UDI-DI) und dem UDI Production Identifier (UDI-PI) noch die Basis UDI-DI benötigt.
MDR (Medical Device Regulation) und IVDR (In-vitro-Diagnostika Regulation) definieren die Basis UDI-DI als die primäre Kennung eines Produktmodells, welche auf Ebene der Gebrauchseinheit des Produkts zugewiesen wird. Sie ist das wichtigste Ordnungsmerkmal für Datensätze in der UDI-Datenbank und ist in den einschlägigen Bescheinigungen und EU-Konformitätserklärungen ausgewiesen.
Zur Zuweisung der Basis UDI-DI verwenden Sie die GMN – Global Model Number.
Um die GMN-Prüfzeichen zu berechnen oder Ihre GMN (Basis UDI-DI) zu überprüfen, können Sie den von GS1 entwickelten Prüfzeichenpaarrechner verwenden. Klicken Sie hier, um darauf zuzugreifen.
Die Basis UDI-DI kennzeichnet ein Produktmodell oder eine gesamte Produktfamilie. Neben derselben Basis UDI-DI besitzt jedes einzelne Produkt aus dieser Produktfamilie eine eigene eindeutige Nummer. Diese Nummer ist die UDI-DI.
Die Basis UDI-DI erscheint in der EUDAMED-Datenbank und in den offiziellen Dokumenten. Sie erscheint nie auf dem Produkt oder deren Verpackung.
Die UDI-DI erscheint in der EUDAMED-Datenbank und auf den Produkten und/oder ihrer Verpackung.
Mit dem GS1 Prüfzeichenpaarrechner können Sie ganz einfach ein Prüfzeichen für Ihre Basis UDI-DI (GMN) generieren oder validieren. Der Rechner steht Ihnen hier zur Verfügung.
Mit Hilfe der GS1 Standards können Sie als Hersteller von Medizinprodukten und In-vitro-Diagnostika die UDI Anforderungen für Europa und die USA erfüllen. Gleichzeitig bilden die GS1 Standards auch die Basis, um Prozesse im Unternehmen und mit den Geschäftspartnern in der Logistik und im Bestellwesen effizienter zu gestalten und die Patientensicherheit zu erhöhen – ein Grund mehr, sich frühzeitig mit der Umsetzung zu beschäftigen.
Als GS1 Complete Kunde haben Sie Zugang zu allen benötigten GS1 Standards. Um Ihre Produkte UDI-konform zu kennzeichnen, sind folgende Schritte erforderlich:
1. GTIN (Global Trade Item Number) erstellen
Anhand der Ihnen zugeteilten GLN erstellen Sie selbst die GTINs mit der entsprechenden Prüfziffer. Alternativ können Sie die GTINs inkl. Prüfziffer mit GS1 Complete direkt mitbestellen.
2. UDI-DI zuteilen
Teilen Sie die GTINs entsprechend den GTIN Vergaberegeln Ihren Produkten zu – fertig ist der UDI-DI.
3. UDI-PI definieren
Legen Sie fest, welche weiteren Informationen (z.B. Charge, Verfallsdatum) als UDI-PI im UDI-Träger verschlüsselt werden sollen.
4. Basis UDI-DI definieren
Für die Basis UDI-DI verwenden Sie die Global Model Number (GMN) – die Basis UDI-DI wird in Europa für die Bereitstellung der Stammdaten in der EUDAMED und die Zuordnung aller relevanter Dokumente benötigt. Die GMN wird auch anhand Ihrer GLN erzeugt, allerdings niemals in einem Barcode verschlüsselt.
5. GS1 Barcodes generieren
Entscheiden Sie, welchen GS1 Barcode (z.B. EAN-13, GS1-128 oder GS1 DataMatrix) Sie als UDI-Träger für das Produkt verwenden möchten. Schließlich können Sie mit Hilfe entsprechender Software-Lösungen den gewünschten GS1 Barcode unter Berücksichtigung des GS1 Datenbezeichner-Konzepts für UDI-DI und UDI-PI erzeugen.
6. Qualitätsprüfung
Vergewissern Sie sich im Rahmen der Qualitätsprüfung, dass die erstellten GS1 Barcodes den GS1 Spezifikationen entsprechen.
Sie benötigen Unterstützung?
Zusätzlich kann GS1 Germany Sie gezielt durch eine individuelle Beratung bei der Umsetzung von UDI unterstützen. Vielleicht auch interessant? Unser UDI Seminar – auf Ihre Bedürfnisse zugeschnitten.
Sie sind noch kein GS1 Complete Kunde und möchten UDI mit den GS1 Standards umsetzen?
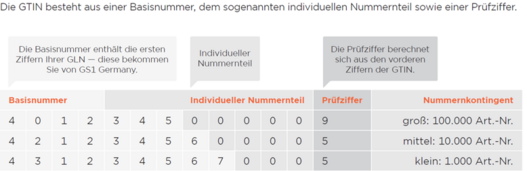
Jede GTIN (vormals EAN) besteht aus einem Teil der individuellen GLN (Globalen Lokationsnummer), einer frei wählbaren Ziffernfolge sowie einer Prüfziffer.
Die GLN erwerben Sie mit GS1 Complete. Auf Basis Ihrer GLN bilden Sie dann die GTIN für Ihre Produkte. Dabei gehen Sie wie folgt vor:
- An den Anfang der GTIN stellen Sie die ersten 7, 8 oder 9 Stellen Ihrer GLN
- Anschließend weisen Sie Ihren Produktvarianten fortlaufende Nummern zu, zum Beispiel 001, 002
- Nun fehlt nur noch die letzte Zahl, die sogenannte Prüfziffer, die bei jeder neu vergebenen GTIN zu errechnen ist. Die Prüfziffer können Sie über unseren kostenfreien Prüfziffernrechner ermitteln.
Eine GTIN kann eine acht-, zwölf-, dreizehn- oder vierzehn-stellige Ziffernkette sein.
Wenn eine dieser GTINs in einem Datenträger verschlüsselt wird, der für die GTIN ein 14-stelliges Feld vorgibt (GS1-128, GS1 DataMatrix), werden kürzere GTINs mit führenden Nullen aufgefüllt. Die führenden Nullen dienen lediglich als Füllfelder und verändern nicht die betreffende GTIN.
Für die Registrierung der GTIN als UDI-DI in der EUDAMED ist ebenfalls ein 14-stelliges Format zu berücksichtigen.
Die UDI-PI ist ein numerischer oder alphanumerischer Code, mit dem die Produktionseinheit des Produkts gekennzeichnet wird.
Zu den verschiedenen Arten der UDI-PI gehören die Seriennummer, die Losnummer, die Software-Identifikation und das Herstellungs- oder Verfallsdatum oder beide Daten.
Wird auf der Kennzeichnung eine Losnummer, eine Seriennummer, eine Software-Identifikation oder ein Verfallsdatum angegeben, so sind diese Daten Teil der UDI-PI.
Hierfür können Sie die GS1 Datenbezeichner (DB) – englisch: Application Identifier (AI) – verwenden.
Wenn das Produktions- und/oder Verfallsdatum als UDI-PI (Production Identifier) in einen GS1 Barcode (linear oder 2D) kodiert wird, dann ist ab dem 1. Januar 2025 eine neue Regel für die Angabe des Tags zu berücksichtigen. Ab diesem Datum DARF der Tag eines Monats NICHT mehr mit zwei Nullen dargestellt werden, sondern es MUSS ein gültiger Tag eines Monats angegeben werden (z. B. der letzte Tag im Juli = 31).
Die Informationen hierzu finden Sie in den Allgemeinen GS1 Spezifikationen unter den jeweiligen GS1 Datenbezeichner (englisch: GS1 Application Identifier -AI):
Produktionsdatum – AI 11
Verfallsdatum – AI 17


Grundsätzlich sind die in MDR/IVDR gelisteten Anforderungen an UDI-Träger zu berücksichtigen. Diese finden Sie in: MDR/IVDR Anhang VI Teil C Absatz 4.
Mit den GS1 Barcodes können Sie alle angeforderten Informationen maschinenlesbar darstellen. In Frage kommen:
- GS1-128: Linearer Strichcode
- GS1 DataMatrix: Zweidimensionaler Code
- RFID: Zusätzlich zu den GS1 Barcodes können Sie auch die RFID-Technologie verwenden
Um bei Medizinprodukten mit einem hohen Individualisierungsgrad die Menge an Dateneinträgen in der EUDAMED-Datenbank einzuschränken, trat im Juli 2023 eine neue Durchführungsverordnung in Kraft, die bis 9. November 2025 vollumfänglich zu erfüllen ist.
Kontaktlinsen im Fokus der neuen Master UDI-DI
Stark individualisierte Produkte mit eindeutigen klinischen Ähnlichkeiten werden unter einer sogenannten „Master UDI-DI“ zusammengefasst. Derzeit sind ausschließlich Kontaktlinsen betroffen oder anders formuliert: nur für Kontaktlinsen darf derzeit die Master UDI-DI verwendet werden. Zukünftig geplante Verordnungen könnten weitere Medizinprodukte abdecken (z.B. Brillen).
Neuer GS1 Standard entwickelt
Im Mai 2024 wurde der neue GS1 Standard für die Umsetzung der Master UDI-DI ratifiziert und kann hier abgerufen werden.
Weitere Details zu Unique Device Identification
Die US-amerikanische FDA (Food and Drug Administration) hat die Regelungen zu UDI bereits am 24. September 2013 verabschiedet. GS1 ist eine der genannten FDA UDI Issuing Agencies. Weitere Details zu den US UDI-Anforderungen erhalten Sie über die Website der FDA oder über die Website von GS1 US.
Global UDI Database (GUDID)
Über das weltweite Netzwerk zum Datenaustausch GDSN können die Hersteller die Produktinformationen an die US-amerikanische FDA UDI-Datenbank (GUDID) liefern. Hier geht es direkt zur (GUDID) Implementation Guideline - ©2018 GS1 AISBL.
US UDI-Timeline
Eine ausführliche Übersicht gibt es hier: US UDI-Timeline
Die Medical Device Regulation (MDR) und die In-Vitro Diagnostic Regulation (IVDR) sind seit 25. Mai 2017 in Kraft. Mit Durchführungsbeschluss (EU) 2024/2120 der EU-Kommission vom 30. Juli 2024 wird die Verlängerung der Benennung der Zuteilungsstellen, die für den Betrieb eines Systems zur Zuteilung von eindeutigen Produktidentifikationen (UDI) im Bereich der Medizinprodukte benannt wurden, bekannt gegeben.
Folgende Gültigkeitstermine gelten:
26. Mai 2021: MDR (bitte beachten Sie die angepassten Übergangsfristen)
26. Mai 2022: IVDR
Laufende Updates zu MDR und IVDR erhalten Sie auch auf der Website der Europäischen Kommission für Medizinprodukte.
Hier geht es zum UDI Helpdesk der Europäischen Kommission.
EUDAMED
Hersteller sind verpflichtet, die Daten über sich und über ihre Produkte in der EUDAMED zu speichern. Zu den Produktinformationen zählen hierbei auch die UDI-Informationen. Hier finden Sie die aktuellsten Informationen der Europäischen Kommission zum EUDAMED Modul „UDI/Devices“.
EUDAMED
Ab 26. Mai 2022 sind für Medizinprodukte und für In-Vitro-Diagnostika neue oder geänderte Daten in der EUDAMED (u.a. mit den UDI-Informationen) zu hinterlegen – unabhängig von der Risikoklasse.
Bitte beachten Sie bzgl. der Timeline die Informationen der EU Kommission zur EUDAMED und die Dokumente der Medical Device Coordination Group (MDCG).
UDI-Träger
Das Anbringen eines UDI-Trägers auf der Kennzeichnung Ihrer Produkte und auf allen höheren Verpackungsebenen (ausgenommen sind Versandcontainer) erfolgt, je nach Einstufung des Produkts in den folgenden Risikoklassen:
| Risikoklasse | Timeline |
|---|---|
| MD Klasse III (MDR Art. 123 Abs. 3f) | 26. Mai 2021 |
| MD Klasse II (MDR Art. 123 Abs. 3f) | 26. Mai 2023 |
| MD Klasse I (MDR Art. 123 Abs. 3f) | 26. Mai 2025 |
| IVD Klasse D (IVDR Art. 113 Abs. 3e) | 26. Mai 2023 |
| IVD Klasse B & C (IVDR Art. 113 Abs. 3e) | 26. Mai 2025 |
| IVD Klasse A (IVDR Art. 113 Abs. 3e) | 26. Mai 2027 |
Für wiederverwendbare Produkte, bei denen der UDI-Träger direkt auf das Produkt aufgebracht werden muss, gelten die Fristen jeweils 2 Jahre später.
Downloads zu Unique Device Identification

TOP 5 Schritte zur Umsetzung von UDI
Damit Sie erfolgreich durch starten und Ihre Prozesse effizient und sicher ausrichten können, haben wir für Sie die TOP 5 Schritte zur Umsetzung von UDI in Europa zusammen gestellt.

GS1 Standards für Stammdaten
Maximale Patientensicherheit. Optimale Wirtschaftlichkeit.
Weitere Informationen (in Englisch)
- GS1 International
- GS1 AIDC (Automatic Identification and Data Capturing) Healthcare Guideline
- GTIN Allocation Rules for the Healthcare Sector
- GS1 General Specifications – immer auf dem aktuellsten Stand
- Factsheet for healthcare professionals and health institutions
Sie haben Fragen zur Umsetzung von UDI mit den GS1 Standards oder zur Unique Device Identification allgemein? Unser UDI-Support hilft Ihnen gerne weiter.